> Insights > Sonderthema zur tiefgreifenden Interpretation der Qualität von GMP-Produkten - Thema 1 
Die Qualität der Materialien und Reagenzien, die im Produktionsprozess der Zell- und Gentherapie (CGT) verwendet werden, spielt eine entscheidende Rolle bei der Bestimmung der endgültigen Produktqualität und therapeutischen Sicherheit. Dies ist besonders wichtig für den Schutz vor exogener Kontamination, d. h. der unbeabsichtigten Einbringung von Verunreinigungen wie Bakterien, Pilzen, Mykoplasmen und Viren in Rohmaterialien, Zellsubstrate und Herstellungsprodukte. Im Allgemeinen sollten Sponsoren eine angemessene Qualitätskontrolle von Materialien und Reagenzien sicherstellen, um unangemessene Risiken für Probanden oder Patienten zu minimieren, z. B. durch Sterilisation oder Sterilitätstests, um sicherzustellen, dass keine mikrobiellen und viralen Verunreinigungen vorhanden sind. Eine strenge Qualitätskontrolle der in der CGT-Produktion verwendeten Rohstoffe ist eine notwendige Maßnahme, um das Risiko einer Kontamination der CGT-Endprodukte durch exogene Faktoren zu verringern und die Sicherheit und Wirksamkeit der CGT-Produkte zu gewährleisten.
Um die Sicherheit künftiger Therapeutika zu gewährleisten, haben die Aufsichtsbehörden in der ganzen Welt einschlägige Anforderungen an die Sicherheit der in der CGT-Produktion verwendeten Rohstoffe festgelegt. Die FDA empfiehlt insbesondere die Verwendung leicht verfügbarer und praktikabler Materialien und Reagenzien von höchster Qualität für die CGT-Produktion. Diese Materialien und Reagenzien werden häufig als "GMP-Qualität" bezeichnet oder als zur Herstellung von Zelltherapien geeignet angegeben. Zu den wichtigsten Regulierungsdokumenten gehören:
(1) Die von der FDA im April 2008 veröffentlichte "Content and Review of Chemistry, Manufacturing, and Controls (CMC) Information for Human Somatic Cell Therapy Investigational New Drug Applications".
(2) USP<1043> "Ancillary Materials for Cell, Gene, and Tissue-Engineered Products".
(3) EP 5.2.12 "Raw Materials of Biological Origin for the Production of Cell and Gene Therapy Medicinal Products".
In allen drei Regelwerken wird die Sicherheit von Rohstoffen erwähnt und die Bedeutung der Sicherheit hervorgehoben.
Unsere GMP-gerechten Produkte wurden unter Berücksichtigung umfassender Sicherheitsaspekte konzipiert und entwickelt, einschließlich der Kontrolle exogener Kontaminationsfaktoren während des gesamten Produktions- und Qualitätskontrollprozesses. Hier sind die wichtigsten Aspekte:
1. Die für die Produktion verwendete Zelllinie ist gut dokumentiert und kann bis zur ECACC als Quelle zurückverfolgt werden.
2. Die Produktionswirtszellen, HEK293, werden nach ihrer Domestizierung und Etablierung umfassenden Tests unterzogen (26 Punkte).
Die Prüfung wird von einer international anerkannten dritten Prüforganisation in Übereinstimmung mit den folgenden Vorschriften durchgeführt:
• ICH Q5 Teil III: Cell Line Characterization: viral testing.
• FDA's "Points to Consider in the Characterization of Cell Lines Used to Produce Biologicals" (1993), insbesondere der Abschnitt "V. QUALITY CONTROL TESTING".
• FDA's "Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications" (2010).
3. Die manipulierten Zellen werden nach dem Aufbau der Zellbank weiter getestet. Die Tests, die von einer bekannten inländischen Prüfstelle durchgeführt werden, umfassen unter anderem Sterilität, Mykoplasmen, Zellmorphologie, verschiedene Inokulationsmethoden von Indikatorzellen in vitro sowie den Nachweis von Retroviren und exogenen Viren.
4. In der vorgeschalteten Zellkulturstufe wird ein chemisch definiertes Medium (CDM) als wohldefiniertes Kulturmedium verwendet. Alle im vorgelagerten Produktionsprozess verwendeten Materialien sind serumfrei (SF) und frei tierischen Ursprungs (AOF). Zellgewinnung und Amplifikation werden in einer Biosicherheitskabine (BSC) der Klasse C durchgeführt. In der Reaktorproduktion werden geschlossene Einwegsysteme und aseptische Schweißtechnik eingesetzt. Die verschiedenen Produktionsstufen sind voneinander getrennt, um das Risiko von Verunreinigungen und Kreuzkontaminationen zu minimieren.
5. Bei der Entwicklung nachgeschalteter Reinigungsverfahren werden Schritte zur Entfernung/Inaktivierung von Viren wie die Behandlung mit niedrigem pH-Wert und die Nanofiltration eingeführt. Für kritische Schritte wird auch eine Validierung des Entkeimungsprozesses durchgeführt (in Arbeit). Für den Reinigungsprozess werden projektspezifische Trennsäulen und chromatografische Medien verwendet, um Kreuzkontaminationsrisiken zwischen verschiedenen Produktionsstufen zu vermeiden.
Die folgenden Vorschriften enthalten Richtlinien zur Virussicherheit:
• Bewertung der Virussicherheit von Biotechnologieprodukten, die aus Zelllinien menschlichen oder tierischen Ursprungs gewonnen werden. 1999. International Conference on Harmonization(ICH)Q5A(R1).
• Leitfaden zur Bewertung der Virussicherheit von biotechnologischen Prüfpräparaten. EMEA /CHMP / BWP / 398498 / 2005. Europäische Arzneimittelbehörde (EMA). 2009.
• Bewertung der Virussicherheit von Biotechnologieprodukten, die aus menschlichen oder tierischen Zelllinien gewonnen werden. Allgemeine USP-Kapitel.
6. Die Herstellung der Formulierung erfolgt in einer strengen Produktionsumgebung der Klasse B+A. Nach der Sterilisationsfiltration wird das Halbfabrikat mit vollautomatischen Anlagen und einem sterilen Einweg-Abfüllsystem verarbeitet. Vorgänge wie die aseptische Montage von Komponenten, das Abfüllen, Verschließen, die automatische Zuführung und Entnahme sowie die Gefriertrocknung werden in einer reinen Umgebung der Klasse B+A durchgeführt (überwacht durch das kontinuierliche Umgebungsüberwachungssystem PMS). Nach der Gefriertrocknung werden die Fläschchen in einer Umgebung der Klasse C+A versiegelt. Die fertigen Produkte werden einer manuellen Kontrolle, Etikettierung und anderen Vorgängen unterzogen, bevor sie nach bestandener Qualitätsprüfung freigegeben werden.
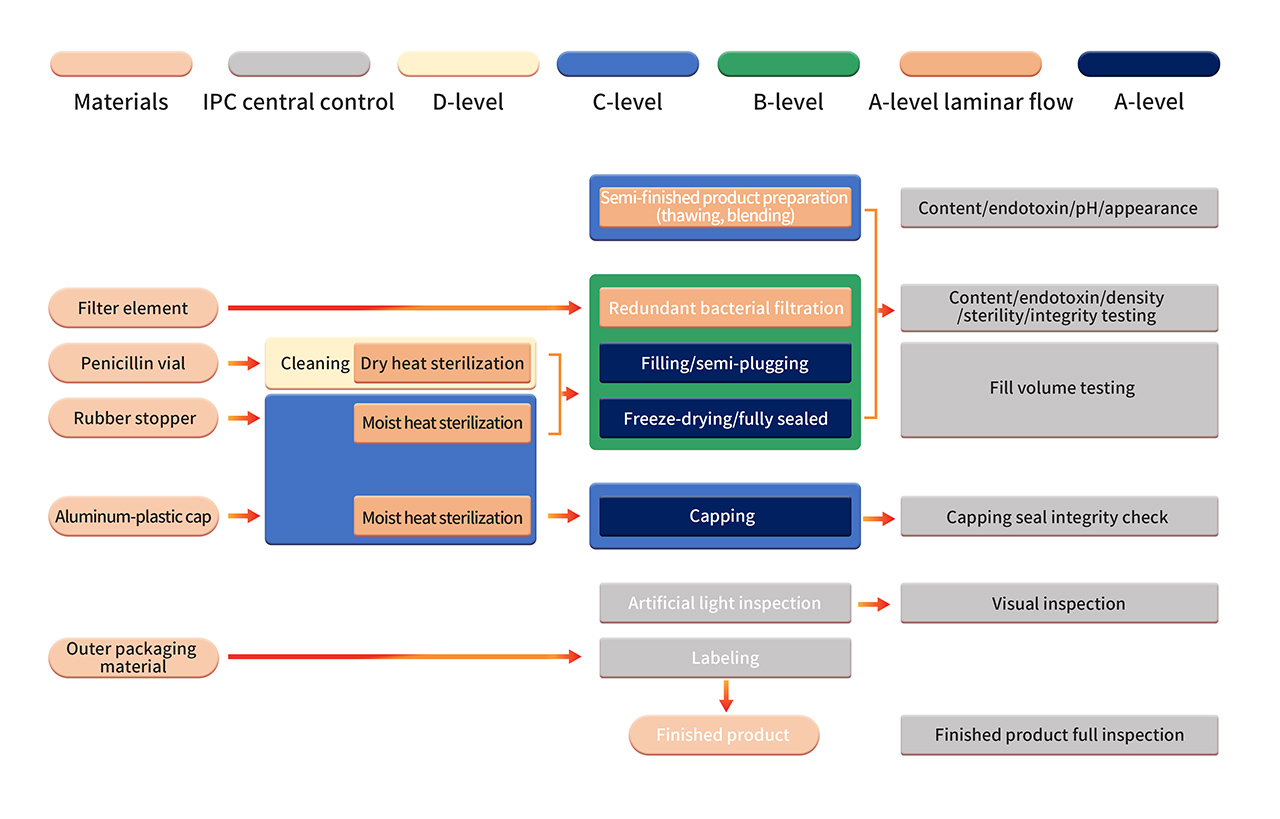
7. Die strenge aseptische Prozessvalidierung umfasst die regelmäßige Bestätigung der aseptischen Prozesskontrolle, einschließlich der Verwendung von aseptischen Nährmedien und/oder Produktersatzstoffen in APS (Mediensimulationsbehältern). APS bewertet alle aseptischen Vorgänge, die von der Sterilisation und Reinigung von Prozessmaterialien bis zum Verschließen von Behältern durchgeführt werden. Es werden verschiedene bekannte aseptische Verfahren und Eingriffe unter normalen Produktions- und Worst-Case-Bedingungen betrachtet.
Referenzverordnung:
• EU-GMP Anhang 1.
8. Die für die Herstellung verwendeten Rohstoffe und Verpackungsmaterialien werden aus Rohstoffen in pharmazeutischer Qualität ausgewählt. Materialien, die in der GMP-Produktion verwendet werden, werden von Forschungs-, Produktions- und Qualitätsteams gemeinsam bewertet und klassifiziert. Die wichtigsten Materialien entsprechen den Anforderungen der einschlägigen Vorschriften und Pharmakopöen und ihre Qualitätsstandards werden durch kritische Charakterisierungsanalysen festgelegt. Der Prozess der Materialverwaltung sieht wie folgt aus:
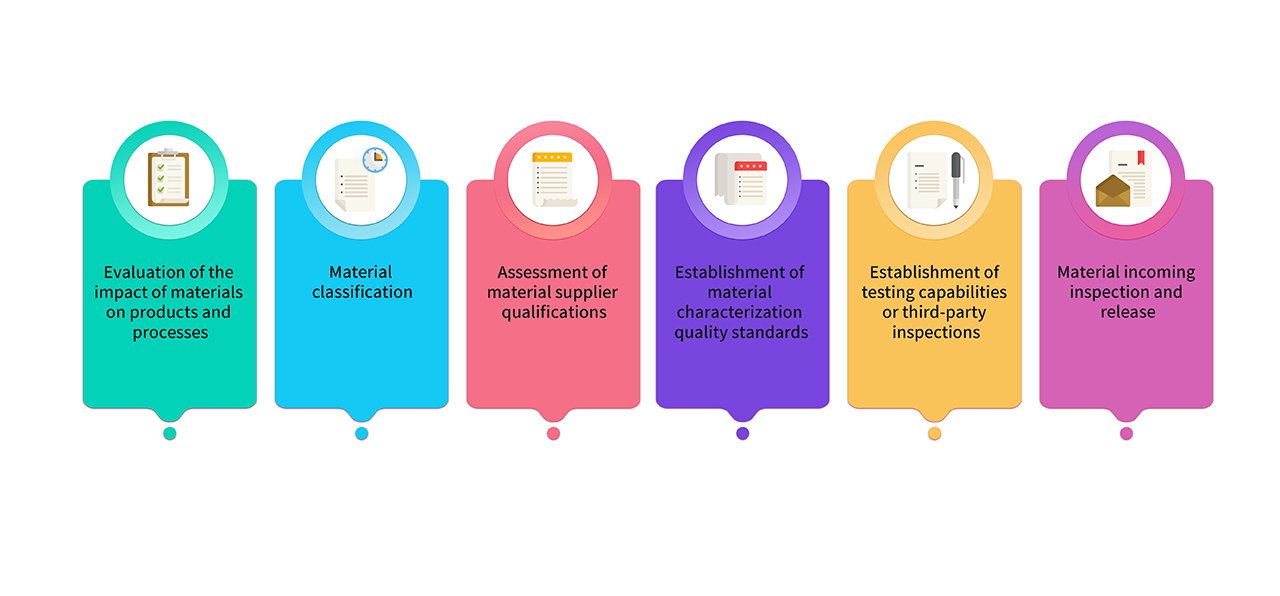
Unsere Produkte in GMP-Qualität werden nicht nur in einer pharmazeutischen Produktionsstätte hergestellt, sondern auch gemäß den einschlägigen nationalen und internationalen CGT-Vorschriften entwickelt und kontrolliert. Wie am Beispiel von IL-15 in GMP-Qualität veranschaulicht, umfasst unsere Freigabe zur Qualitätskontrolle des Endprodukts die folgenden Punkte:
• SDS-PAGE>95%
• Endotoxingehalt weniger als 10 EU/mg
• Restgehalt an Wirtszell-DNA weniger als 0,02ng/μg
• Restgehalt an Wirtszellprotein weniger als 0,5ng/μg
• Biologische Aktivität >0,8 ×107 IU/mg (Verweis auf das WHO Human IL-15 (NIBSC-Code: 90/530) als Standard)
• Mikrobische Prüfung
• Mykoplasma-Tests
• In-vitro-Virustest
• Konsistenz von Charge zu Charge
• Umfassende Unterstützung von Stabilitätsdaten (beschleunigte, Einfrieren/Auftauen-, Langzeit-, Versandstabilitätsprüfung)
ACROBiosystems führt während des gesamten Prozesses der Entwicklung, Produktion, Qualitätsprüfung und des Qualitätssystems strenge Kontrollen potenzieller exogener Faktoren durch, um die Sicherheit unserer Produkte zu gewährleisten. Wir sind bestrebt, qualitativ hochwertige Reagenzien für den klinischen Einsatz in der Zell- und Gentherapie zu entwickeln und die Standards der Arzneimittelproduktion mit strengen Qualitätsmanagement- und Freigabetests zu kombinieren, um unseren Kunden bessere und sicherere Produkte in GMP-Qualität zu bieten!
GMP Produktqualität Tiefgreifende Interpretation Spezialserie Trailer ist da!
• Kontrolle externer Verunreinigungen bei der Herstellung von kritischen Materialien für Zell- und Gentherapien.
• Aseptische Schutzstrategien für die Produktion kritischer Materialien für CGT
• Qualitätskontrollsystem für kritische Materialien in CGT
• Globales System zur Sicherung der Lieferkette für kritische Materialien in CGT
• Wie man die regulatorischen Anforderungen der Vereinigten Staaten für kritische Materialien in CGT besser erfüllen kann
• ...


This web search service is supported by Google Inc.
